Coiffage pulpaire direct, pulpotomie, pulpectomie : où en sommes-nous ?
Les stratégies de la gestion des lésions carieuses profondes ont évolué ces dernières années grâce aux thérapeutiques de préservation de la vitalité pulpaire que sont le coiffage direct, la pulpotomie partielle et la pulpotomie complète. Ce changement de paradigme découle des avancées majeures dans la compréhension de la biologie du complexe pulpo-dentinaire. Par ailleurs, le développement de nouveaux biomatériaux de coiffage pulpaire, tels que les ciments hydrauliques à base de silicates de calcium, a rendu les traitements plus prévisibles, tant d’un point de vue histologique que clinique. Malheureusement, la littérature scientifique internationale ne dispose que de peu d’études cliniques randomisées à haut niveau de preuve, et plusieurs questions relatives aux indications, à la procédure et au pronostic restent encore aujourd’hui sans réponse ferme. Malgré ces interrogations, pour le bénéfice des patients, le praticien doit promouvoir, dans sa pratique clinique quotidienne, les stratégies thérapeutiques conservatrices fondées sur la biologie pulpaire.
Les stratégies thérapeutiques contemporaines fondées sur la préservation tissulaire ont permis une nouvelle émergence des thérapeutiques de préservation de la vitalité pulpaire et, ainsi, de repousser les indications des traitements endodontiques dans le cas de lésions carieuses profondes [1]. Il est connu, depuis la fameuse étude de Kakehashi en 1965, qu’une pulpe exposée est capable de conserver sa vitalité dès lors que les conditions biologiques, physiopathologiques et cliniques sont réunies pour qu’un pont minéralisé se forme en fermant la plaie pulpaire [2]. Le tissu pulpaire ainsi isolé recouvre alors son état de santé et ses fonctions.
Mais la mise en pratique clinique de cette connaissance biologique n’a pas été aussi unanime qu’espérée. La compréhension récente des mécanismes biologiques intervenant dans la réparation et dans la régénération tissulaire ainsi que les avancées dans le domaine des biomatériaux permettent de reconsidérer dans notre arsenal thérapeutique, dès que cela est possible, les thérapies ayant pour objectif de conserver la pulpe fonctionnelle. Les techniques d’éviction carieuse partielle permettant de diminuer le risque d’exposition pulpaire durant le curetage carieux ou les techniques de coiffage pulpaire direct, pulpotomies partielle ou complète conservent la vitalité pulpaire en étant moins invasif que la pulpectomie [3].
Terminologie et définition des thérapeutiques de préservation pulpaire (fig. 1a-d)
Le coiffage pulpaire indirect est la procédure qui consiste, après curetage de la lésion carieuse, à appliquer un matériau au contact d’une dentine souvent dure. Il faut lui préférer une stratégie de curetage sélectif, laissant in situ une partie de dentine déminéralisée.
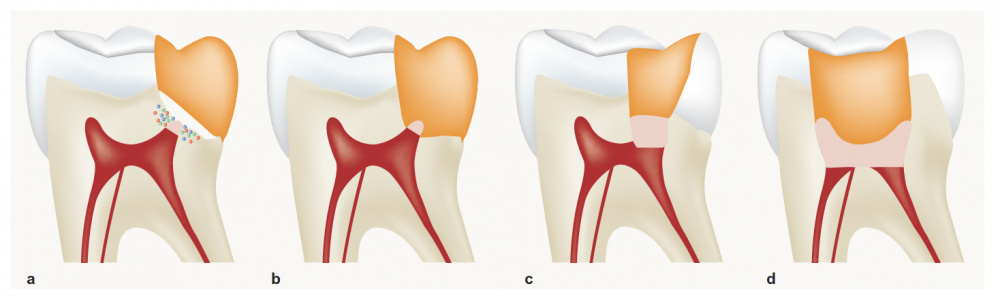
Le coiffage direct est la procédure qui consiste à appliquer un matériau bioactif au contact direct de la plaie pulpaire suivie de la mise en place d’un matériau de restauration coronaire, dans le but de favoriser la réparation et l’oblitération pulpaire par une barrière minéralisée néoformée.
• classe I : exposition pulpaire d’origine non carieuse (traumatique ou iatrogène). Dans ce cas, aucune inflammation pulpaire n’est présente.
• classe II : exposition pulpaire en présence d’une lésion carieuse profonde.
La pulpotomie est la technique qui consiste à sectionner et à retirer tout ou partie de la pulpe camérale afin de préserver la vitalité du tissu pulpaire résiduel.
La pulpotomie partielle correspond à l’exérèse chirurgicale d’une petite portion de la pulpe camérale superficielle, suivie de l’application d’un matériau bioactif au contact de la pulpe résiduelle et de la mise en place d’un matériau de restauration coronaire d’usage.
La pulpotomie complète (également dénommée pulpotomie camérale ou cervicale) correspond à l’élimination de la totalité du parenchyme pulpaire caméral, jusqu’aux orifices canalaires, afin de préserver la vitalité de la partie radiculaire restante. Elle est suivie par la mise en place d’un matériau bioactif et d’une restauration coronaire d’usage.
Le coiffage pulpaire par un biomatériau est un acte opératoire codifié qui, en soi, ne présente pas de difficulté technique majeure. En revanche, la prise de décision et les conditions de sa réalisation clinique sont des éléments déterminants pour le pronostic, conditionnant le succès ou l’échec des thérapeutiques de préservation pulpaire.
Coiffage pulpaire direct, pulpotomie ou pulpectomie ? Pourquoi, quand et comment ? Ce sont les questions cliniques que se pose le praticien dans son exercice quotidien. L’objectif de cet article est d’apporter au praticien, grâce aux connaissances disponibles en 2019 [3], les solutions cliniques envisageables pour préserver au mieux la vitalité pulpaire.
Des bases biologiques pour mieux comprendre la clinique
La meilleure compréhension des mécanismes biologiques impliqués dans la réponse pulpaire permet de mieux appréhender le potentiel réparateur de la pulpe et d’ainsi adapter la thérapeutique. Grâce à cette connaissance, chaque clinicien sera en mesure d’évaluer le potentiel régénérateur du tissu pulpaire et d’envisager, après information au patient, un traitement de préservation de la vitalité pulpaire.
Les réactions de défense du complexe pulpo-dentinaire
Le complexe pulpo-dentinaire réagit face à l’agression par une combinaison de réactions d’inflammation et de réparation, l’équilibre entre les deux étant essentiel pour préserver la vitalité de la pulpe [4].
Plusieurs cellules pulpaires réagissent immunologiquement face aux bactéries, initialement via la reconnaissance des agents pathogènes par les odontoblastes et plus tard par les fibroblastes, les cellules-souches et les cellules immunitaires. Ensuite, une série complexe de réponses inflammatoires antibactériennes, immunitaires, vasculaires et localisées est activée [5-7].
Bien que l’odontoblaste soit une cellule immunocompétente [8], sa principale fonction est la sécrétion de dentine primaire, secondaire (dentine physiologique) et tertiaire (dentine pathologique).
La dentine tertiaire est un tissu cicatriciel synthétisé en réponse à une inflammation. Selon l’intensité du stimulus et la nature des lésions induites dans la pulpe, on distingue deux types de dentine tertiaire : la dentine réactionnelle et la dentine réparatrice [9-11].
Dans les cas où les stimuli sont de faible intensité (lésions carieuses à progression lente, attrition modérée, érosion ou fracture superficielle), les odontoblastes peuvent survivre et contribuer à produire une barrière minéralisée de protection efficace par la mise en place d’une dentine réactionnelle, ce qui permet au tissu pulpaire sous-jacent de conserver sa fonction.
La stratégie essentielle, dans ces situations, est de préserver et protéger la palissade odontoblastique en scellant la plaie dentinaire, ce qui peut être obtenu par un scellement dentinaire adhésif immédiat ou le placement d’un biomatériau faisant fonction de coiffage pulpaire indirect (verres ionomères, ciments di- ou tri calciques), recouvert le plus souvent par une restauration d’usage.
Lorsque les stimuli sont plus importants et/ou progressent rapidement, comme dans les cas de carie dentinaire profonde, les odontoblastes (cellules post-mitotiques ayant perdu la possibilité de se diviser) sont détruits. Lorsque l’environnement est favorable (élimination du tissu carieux, mise en place d’un biomatériau), un tissu minéralisé (pont dentinaire, dentine réparatrice) est mis en place pour protéger la pulpe (fig. 2).
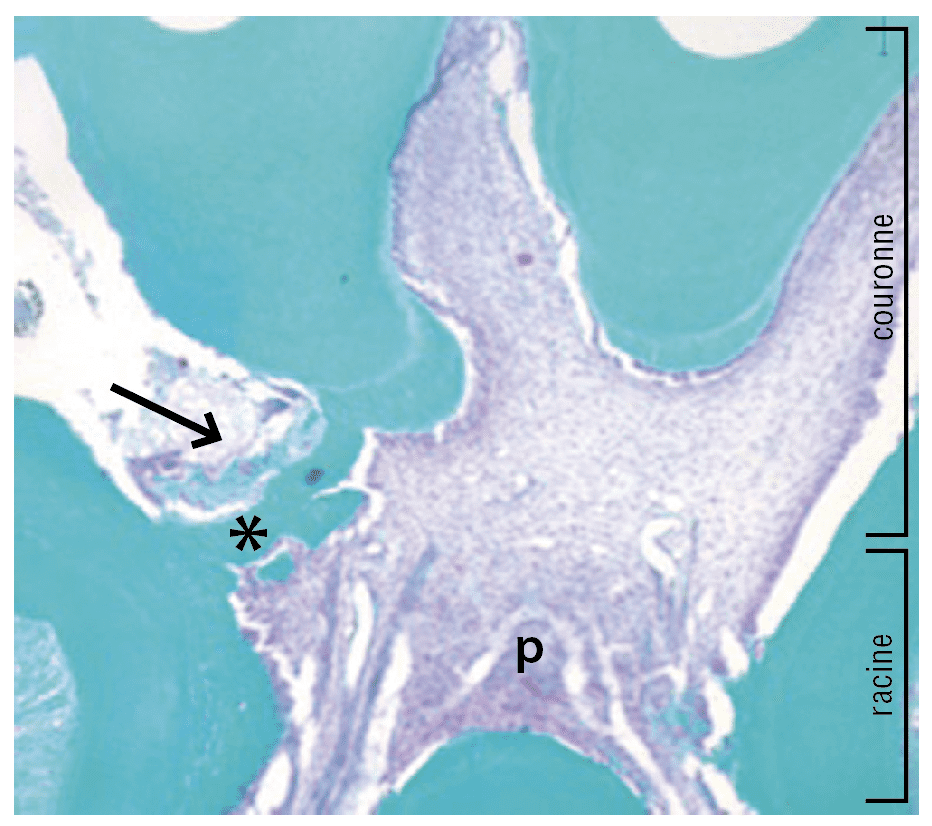
Ce processus nécessite le recrutement de nouvelles cellules qui vont se différencier en pseudo-odontoblastes (ou odontoblast-like cells). Ces pseudo-odontoblastes proviendraient de fibroblastes pulpaires et de cellules-souches (mésenchymateuses indifférenciées ou péricytes, cellules entourant les vaisseaux périphériques) [12-15].
Ces cellules seraient capables de sécréter une dentine réparatrice [13,16]. Les différents événements cellulaires impliqués dans la dentinogenèse réparatrice sont orchestrés par des molécules bioactives comme les facteurs de croissance [17] séquestrés au sein de la matrice dentinaire et libérés lors de la déminéralisation dentinaire d’origine carieuse ou par l’utilisation de solutions ou de biomatériaux dentaires [18,19].
La réparation pulpo-dentinaire est donc possible, dans un environnement favorable, grâce à l’utilisation de matériaux bioactifs, à la condition que l’état de santé pulpaire soit compatible avec l’expression de son potentiel réparateur.
Les matériaux
Ces matériaux regroupent l’hydroxyde de calcium et la famille de ciments à base de silicate de calcium. L’hydroxyde de calcium Ca(OH2) a été largement utilisé comme agent de coiffage pulpaire depuis plus de soixante-dix ans, et a été longtemps considéré comme le matériau de référence. Le Ca(OH)2 a été initialement introduit, principalement pour son activité dentinogénique. Son utilisation sur la pulpe exposée peut induire une dentinogenèse réparatrice menant à la formation d’un pont minéralisé présentant des porosités. À l’heure actuelle, il ne semble plus être le matériau idéal pour le coiffage pulpaire [3,20].
Les ciments à base de silicate calcique regroupent, entre autres, le MTA (mineral trioxide aggregate) et le matériau Biodentine (Septodont). Le MTA est un matériau bioactif qui a été développé au début des années 1990. C’est essentiellement une préparation raffinée de ciment de Portland, un mélange de silicate dicalcique, de silicate tricalcique, d’aluminate de tricalcium, de gypse et d’aluminoferrite tétracalcique.
En général, les études in vitro indiquent que le MTA est un matériau biocompatible possédant la capacité de stimuler la différenciation ostéo/odontogénique [21]. La capacité du MTA à induire la dentinogenèse réparatrice ou la formation de pont minéralisé a été démontrée dans les études in vivo dans lesquelles le coiffage pulpaire direct et/ou la pulpotomie ont été effectués [20,22-24]. L’inconvénient majeur de ce matériau est le temps de prise (environ deux heures) et un agent radio-opacifiant, responsable de la coloration.
Le matériau Biodentine est un ciment à base de silicate de calcium, développé par le laboratoire français Septodont. Ce matériau est présenté sous la forme de poudre et de liquide, le mélange étant préparé avec un amalgamateur. La poudre est composée de silicate tricalcique, de carbonate de calcium et d’oxyde de zirconium, tandis que le liquide comprend de l’eau, du chlorure de calcium (comme accélérateur de prise) et un agent réducteur d’eau.
Ce matériau possède un temps de prise court (12 minutes) et des propriétés physico-mécaniques améliorées par rapport à celles de MTA [25,26]. Il présente une biocompatibilité similaire à celle du MTA et est capable, in vitro, d’induire la différenciation odontoblastique de cellules pulpaires et la minéralisation de leur matrice dans des modèles de cultures classiques [27-29]. In vivo, il stimule la formation d’une barrière minéralisée lorsqu’il est utilisé en coiffage direct sur la pulpe [20,30]. Il possède une bonne étanchéité avec la dentine et avec les systèmes adhésifs, l’indiquant en tant que substitut dentinaire de choix dans ce champ de thérapeutiques. La technique sandwich fermée sera préconisée, ses propriétés d’adhérence étant insuffisantes pour un sandwich ouvert [25].
En dépit de la tendance en recherche et développement de développer des matériaux hybrides à base de résine et de silicate de calcium pour le coiffage pulpaire direct, l’utilisation de matériaux hybrides ne semble pas indiquée. En effet, très récemment, il a été démontré, in vitro, que les biomatériaux de coiffage pulpaire sans résine avaient un effet sur la réponse anti-inflammatoire et induisaient la capacité de régénération de la pulpe, contrairement à ceux contenant de la résine tels que TheraCal (Bisco), qui modifient la réponse de la pulpe en réduisant le processus de régénération [31].
Sur le plan des propriétés, la bioactivité et l’étanchéité des biomatériaux restaurateurs sont les clés du succès de ces thérapeutiques conservatrices. Il est important d’assurer, d’une part l’étanchéité et de la plaie dentinaire ou pulpaire, et d’autre part l’étanchéité de la restauration sus-jacente par des thérapeutiques adhésives adaptées.
Fort des connaissances concernant les mécanismes biologiques impliqués dans la réparation pulpaire, le praticien prend conscience des potentialités du complexe pulpo-dentinaire ainsi que du bien-fondé des thérapeutiques de préservation de la vitalité pulpaire. Mais à ce jour, dans la prise en charge quotidienne des patients, les thérapeutiques visant à conserver la vitalité pulpaire ne sont pas toujours reproductibles et le succès n’est pas constant. Une des raisons mises en avant par la littérature scientifique est la difficulté à poser le bon diagnostic pulpaire. Le manque d’information sur le statut inflammatoire pulpaire demeure le maillon faible de cette stratégie de préservation de la vitalité pulpaire, ainsi que les conditions opératoires.
Le diagnostic clinique (tabl. I et II)
D’une manière générale, dès qu’il s’agit de préserver la vitalité pulpaire, quelle que soit la situation clinique, il est essentiel, dans un premier temps, d’évaluer le statut inflammatoire de la pulpe à traiter. Ne disposant d’aucun test fiable à 100 %, le diagnostic pulpaire s’établit grâce au recueil des éléments de l’anamnèse, de l’examen clinique et radiologique. L’examen clinique, par la combinaison des tests de sensibilité thermique et électrique, va permettre de localiser les symptômes et la dent causale, d’évaluer les caractéristiques de la douleur, quand elle est présente : intensité (échelle analogique : EVA) ; caractère spontané (facteurs endogènes) et/ou provoqué ; rémanence après stimulus (facteurs exogènes) ; période de survenue (jour, nuit, décubitus), d’identifier les médications déjà prises et leurs effets, en particulier sur la douleur. Le test de percussion axiale renseignera sur une éventuelle inflammation ligamentaire pouvant signer une extension radiculaire de l’inflammation. Ces éléments vont permettre d’identifier une pulpe vivante dans 97 % des cas, et une pulpe nécrosée dans 90 % des cas [32].
L’examen radiographique (rétrocoronaire et rétroalvéolaire) est un examen complémentaire mais essentiel au diagnostic et à la prise de décision clinique. En effet, il évaluera la profondeur des lésions carieuses dentinaires, la proximité pulpaire, la présence ou non d’une épaisseur de dentine en regard de la cavité carieuse dentinaire, la présence d’une réaction de défense du complexe pulpo-dentinaire, la présence d’une image radioclaire périapicale en rapport avec une lésion inflammatoire périradiculaire d’origine endodontique (LIPOE).
Mais le fait de savoir qu’une pulpe est vitale ne renseigne pas sur son état inflammatoire [33]. Or, le niveau d’inflammation pulpaire est le facteur clé de la prise de décision et est garant du succès clinique.
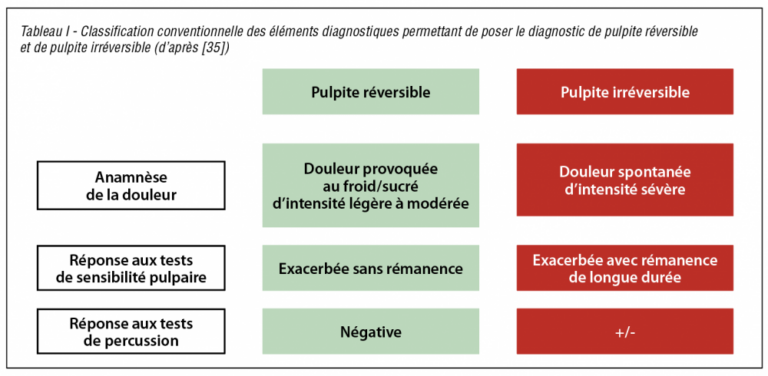
Jusqu’à récemment, le diagnostic de la pulpite est dichotomique : elle est soit réversible, soit irréversible. La différence majeure entre ces deux états est la présence de douleur spontanée et d’intensité très importante avec un test de sensibilité pulpaire exacerbé et rémanent dans la pulpite irréversible (tabl. I). Des études ont permis d’établir qu’il n’y a pas systématiquement de corrélation entre le diagnostic clinique posé grâce aux différents éléments cliniques dont nous disposons et le diagnostic histologique, qui reflète la réalité de l’inflammation pulpaire [34-35]. L’étude récente de Domenico Ricucci et coll. [35] a ainsi démontré que les outils diagnostiques permettent de poser un diagnostic de pulpite réversible avec une fiabilité de 95 %, alors que leur fiabilité pour poser le diagnostic de pulpite irréversible est de 85 %. Par ailleurs, lorsqu’il s’agit de pulpite histologiquement irréversible, bien souvent, seuls les 2 mm les plus coronaires de la pulpe sont dans un état inflammatoire important, voire en nécrose, alors que le reste de la pulpe ne présente que peu de signes pathologiques.
Cliniquement, face à une pulpite réversible, le clinicien a tendance à mettre en œuvre les thérapies de préservation de la vitalité pulpaire, alors que la pulpite irréversible contre-indique cette possibilité conduisant à l’élimination de la totalité du tissu pulpaire par un traitement endodontique. Si l’on se réfère à l’étude de Ricucci, une dent sur six diagnostiquées en pulpite irréversible serait en réalité en pulpite réversible et aurait donc subi un traitement endodontique non justifié.
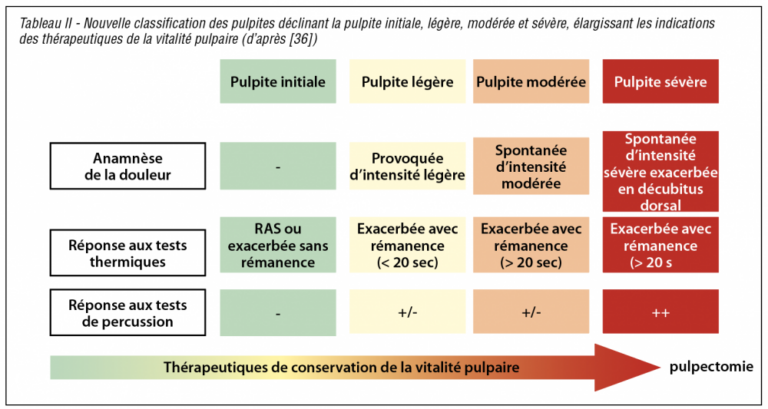
Une nouvelle classification des lésions pulpaires a été proposée en 2017 par Wolters et coll. [36]. Cette classification distingue les stades de pulpite initiale, légère, modérée et sévère, et permet entre autres de ne plus utiliser le terme de pulpite « irréversible » qui, jusqu’ici, condamnait la conservation de la vitalité pulpaire (tabl. II).
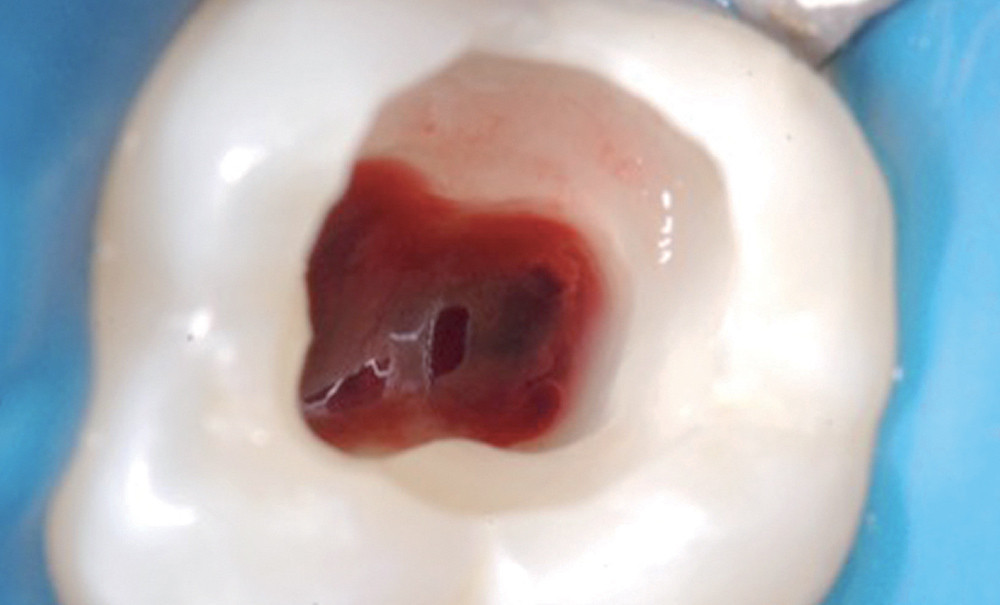
En plus des éléments préopératoires nécessaires à la pose d’un diagnostic, d’autres paramètres peropératoires complètent la prise de décision. Il s’agit de l’examen de la plaie pulpaire. Cet examen vise à observer l’aspect du tissu pulpaire exposé – sain, hémorragique ou ulcéré – et ainsi d’apprécier son degré d’inflammation. Par ailleurs, la durée nécessaire à l’obtention de l’hémostase est aussi une donnée indispensable pour confirmer l’indication d’un coiffage ou d’une pulpotomie dans les cas favorables ou indiquer la pulpectomie si la pulpe présente un état inflammatoire sévère.
À ce jour, devant les faiblesses de nos moyens diagnostiques actuels, de nouveaux outils de diagnostic pulpaire doivent être développés. Plusieurs équipes de recherche travaillent sur des outils basés sur la quantification de marqueurs biologiques de l’inflammation [37-38].
Procédures cliniques
Plusieurs études récentes ont confirmé des taux de succès élevés après élimination non sélective (complète) de la lésion carieuse, entraînant une exposition de la pulpe, et la mise en œuvre d’une procédure de préservation de vitalité pulpaire utilisant un ciment hydraulique à base de silicate de calcium, un microscope opératoire [39,40] et/ou l’utilisation d’un agent désinfectant [41,42].
Les compétences et l’expérience de l’opérateur peuvent également être une variable importante, déterminant le succès de la thérapeutique conservatrice. Une exposition pulpaire intentionnelle en cas de lésion carieuse profonde est une opportunité d’évaluer les dommages causés à la pulpe, la présence ou non de nécrose dans la chambre pulpaire, l’hémorragie pulpaire.
Les critères d’exclusion pour les thérapeutiques conservatrices sont :
– l’impossibilité de mise en place du champ opératoire ;
– une dent dont la restauration nécessite un ancrage radiculaire ;
– l’impossibilité d’obtenir une hémostase dans des délais brefs (voir le descriptif des différentes thérapeutiques) [3] ;
– la présence d’un tissu nécrotique au sein de la totalité de la chambre pulpaire.
Les thérapies conservatrices doivent être fondées sur des procédures d’asepsie strictes. La pose du champ opératoire, la désinfection du site, l’utilisation d’instruments stériles après l’élimination de la carie sont des mesures obligatoires pour que ces thérapeutiques aboutissent au succès.
Coiffage pulpaire direct
Le principe de cette thérapeutique est de traiter la plaie pulpaire dans un environnement tissulaire le plus sain possible, et en limitant au maximum la contamination bactérienne.
Le coiffage pulpaire direct doit être effectué après un curetage non sélectif de la dentine cariée ayant conduit à une exposition pulpaire. Il ne doit donc être effectué que si la dentine environnante est saine et que la pulpe exposée ne présente aucun signe d’infection.
Si ces conditions ne sont pas remplies, des procédures progressivement plus invasives sont indiquées jusqu’à ce que l’aspect clinique indique l’absence d’infection de la dentine et de la plaie pulpaire.
Cette stratégie, que l’on pourrait calquer sur la terminologie de « gradient thérapeutique » initialement proposée en restauratrice par les Drs Tirlet et Attal [43], permettra au clinicien de distinguer les cas où des procédures de pulpotomie peuvent être indiquées de ceux dans lesquels la dégradation de la pulpe étant tellement importante que la pulpectomie est le traitement de choix.
Cliniquement, après une anesthésie locale ou loco-régionale avec un vasoconstricteur, la dent doit être isolée avant exposition pulpaire avec une digue et désinfectée. L’utilisation d’aides visuelles tout au long de la procédure est conseillée pour assurer le retrait de toute la dentine molle et pour l’inspection du tissu pulpaire.
Après le curetage de la dentine cariée, la pulpe est exposée de manière précautionneuse à l’aide de fraises stériles montées sur turbine ou contre-angle bague rouge, sous irrigation constante [44]. L’hémostase doit être obtenue avec des boulettes de coton imbibées idéalement d’hypochlorite de sodium à 1 % ou de chlorhexidine 0,2-2 %.
En cas d’exposition pulpaire en dentine saine (classe I), la plaie pulpaire peut être nettoyée à l’aide de sérum physiologique stérile. Après l’obtention rapide de l’hémostase (en moins de 2 minutes [45]), le biomatériau de coiffage peut être mis en place sans compression sur la plaie pulpaire préférentiellement à l’aide d’un applicateur stérile (Porte-Dycal, MTA Gun, embout en Téflon pour porte amalgame…). Le biomatériau de coiffage recommandé appartient à la famille des ciments hydrauliques à base de silicates calciques (MTA, Biodentine, TotalFill…) (fig. 3a-f).
Fig. 3 – Mise en œuvre d’un coiffage pulpaire direct. Patient présentant une pulpite légère (pulpite réversible) sur 36.
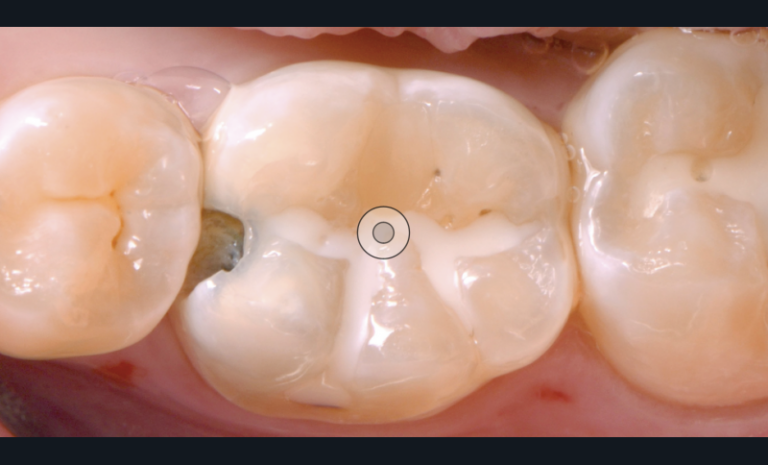
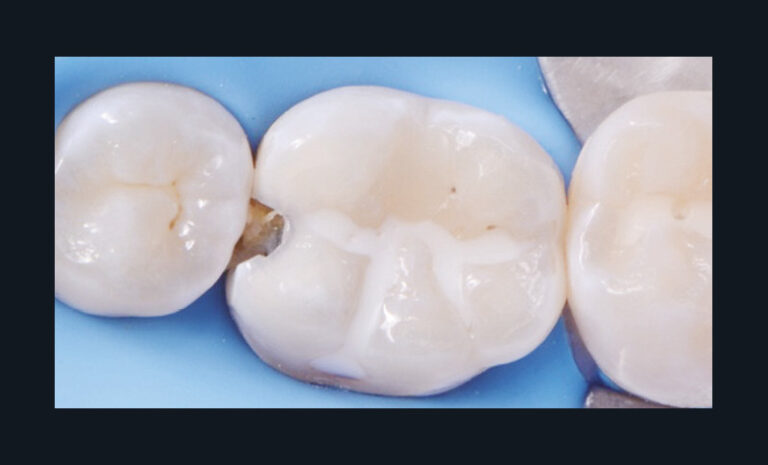
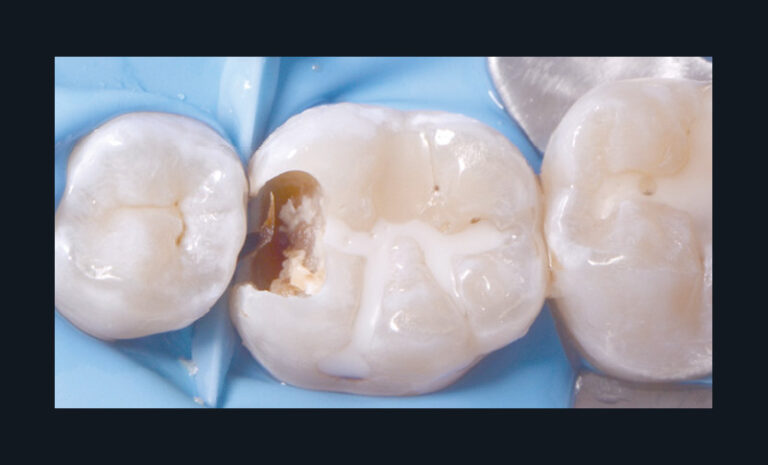
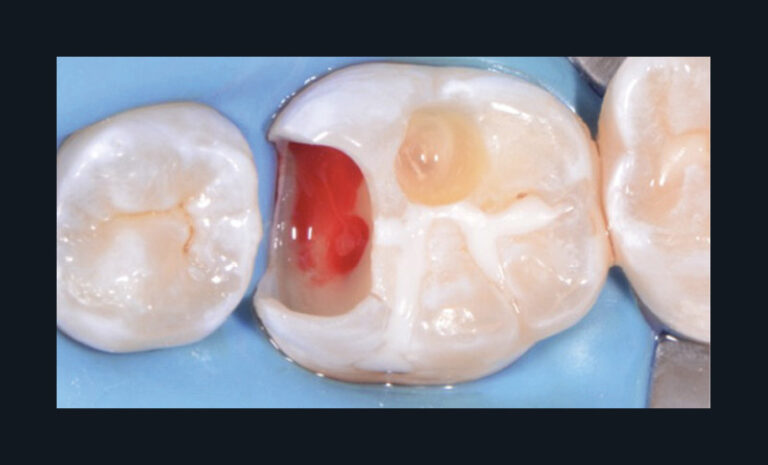
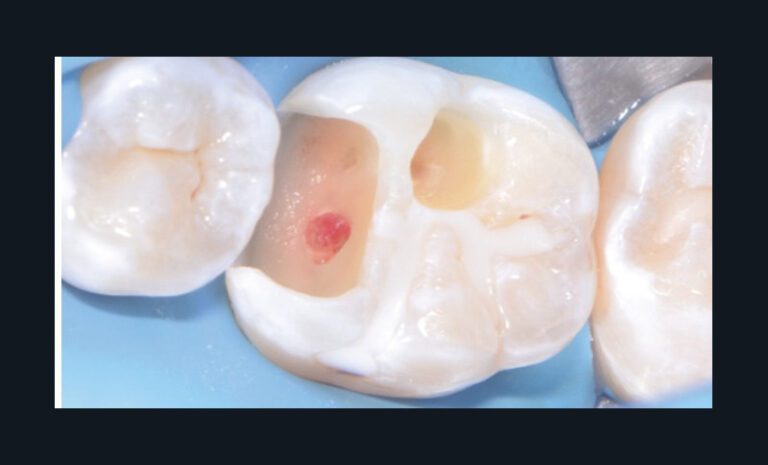
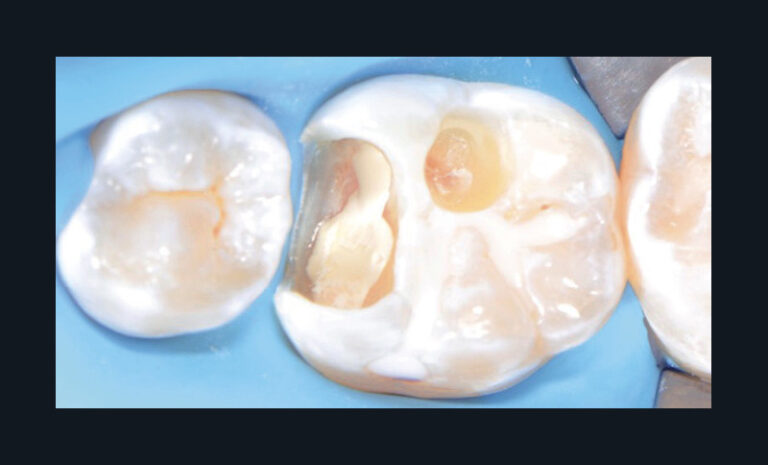
En fonction du matériau sélectionné, une restauration adhésive d’usage pourra être réalisée immédiatement (fig. 4a-c) ; à défaut, le site coiffé sera protégé par une obturation temporaire étanche avec des ciments verres ionomères. Si le matériau utilisé est la Biodentine, celui-ci peut assurer conjointement le matériau de coiffage et la restauration temporaire. En effet, même si l’obturation définitive peut être réalisée le même jour à l’issue des 12 minutes de prise, il semble préférable de différer cette dernière afin d’assurer une prise optimale du matériau.
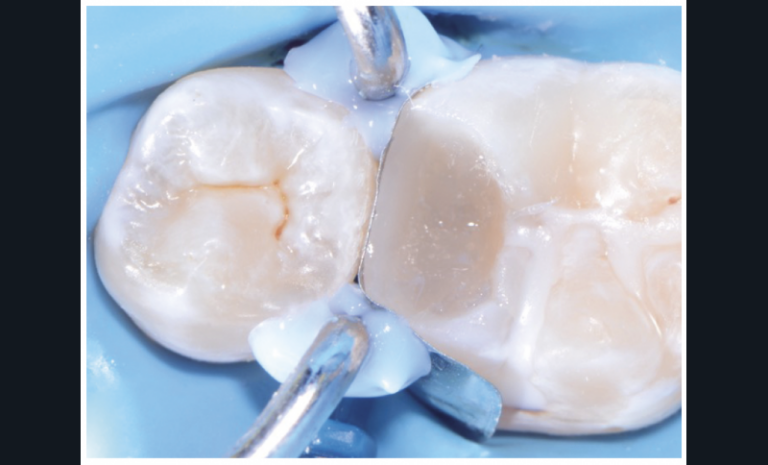
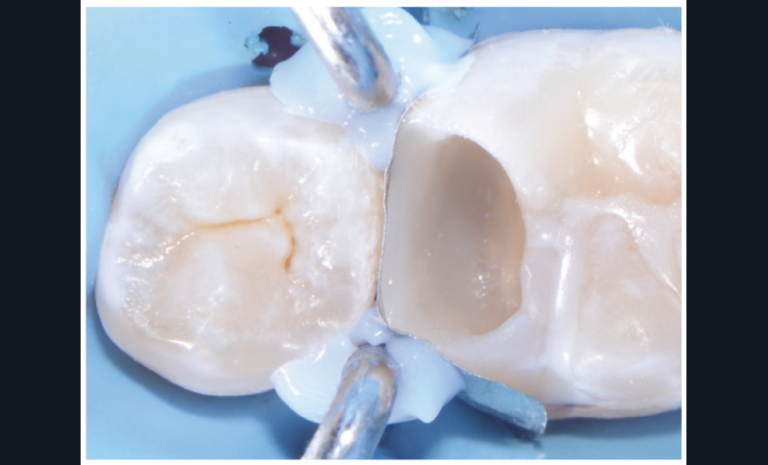
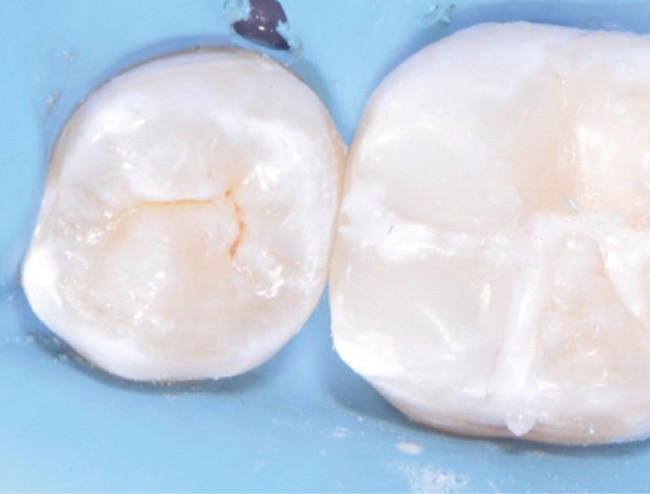
L’utilisation d’adhésif avec mordançage plus rinçage semble préférable [46-47]. Un suivi clinique et radiographique est mis en place pour évaluer le succès ou non de la thérapeutique. Un autre cas de coiffage direct réalisé dans le cadre d’une pulpite légère montre qu’à trois mois, les signes cliniques ont disparu et que les signes radiographiques indiquent une absence de lésion (fig. 5a-c).
Pulpotomie partielle
Le but ultime de la pulpotomie partielle est d’obtenir une plaie chirurgicale propre dans du tissu conjonctif pulpaire non infecté entouré de dentine non infectée minéralisée. Si ces objectifs sont atteints, le nouvel environnement devrait être propice à la guérison. La justification de cette procédure est double : celle-ci sera indiquée dès lors que l’hémostase ne peut être obtenue dans un bref délai (plus de 2 minutes). La prise de décision sera donc peropératoire. Par ailleurs, la décision peut être aussi préopératoire ; en effet, d’un point de vue histologique, en présence de lésion carieuse, il se peut que l’inflammation dissémine au sein de la pulpe camérale.
Ainsi, il paraît souhaitable que la pulpe en contact avec la partie profonde de la lésion carieuse soit éliminée pour faciliter l’éviction physique du biofilm et des tissus pulpaires superficiels enflammés pouvant également contenir des micro-organismes [48-50]. Cependant, l’effet de telles procédures peut dépendre des compétences de l’opérateur et de son équipement (microscope opératoire, par exemple).
Le tissu pulpaire inflammatoire est amputé avec une fraise boule diamantée stérile montée sur turbine ou contre-angle bague rouge, sous irrigation abondante. La désinfection et l’hémostase sont réalisées comme décrit précédemment. Puis, le coiffage du tissu pulpaire est réalisé sans compression avec le biomatériau appartenant à la famille des silicates calciques. La différence technique avec le coiffage direct réside dans le fait que le matériau est maintenu sur une hauteur de quelques millimètres dans l’espace pulpaire permettant de disposer d’une surface et d’un volume suffisants pour le biomatériau de coiffage pulpaire.
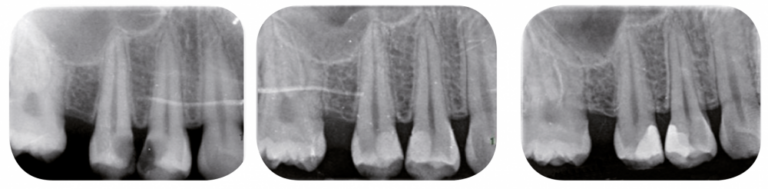
La restauration coronaire est ensuite réalisée comme décrit plus haut, et le suivi est instauré (fig. 6a-f).
Si le degré d’inflammation pulpaire a été sous-évalué, la pulpe est plus hémorragique, du fait de la congestion pulpaire, et l’hémostase sera longue à obtenir, ce qui est préjudiciable pour le pronostic de la pulpotomie partielle. La pulpotomie complète doit alors être préférée.
Pulpotomie complète
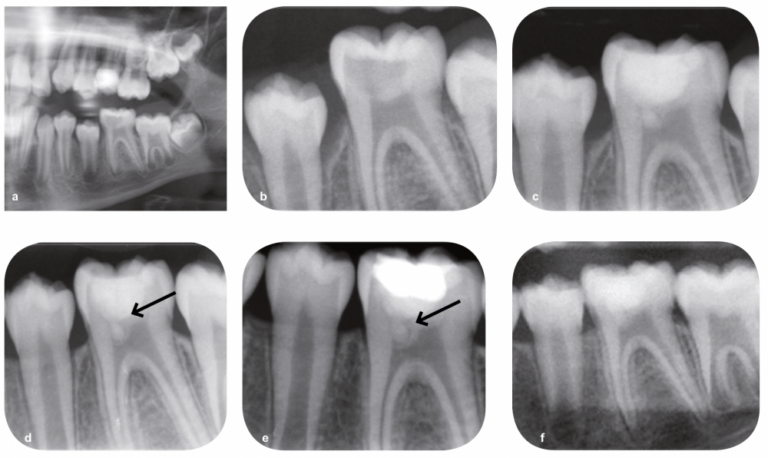
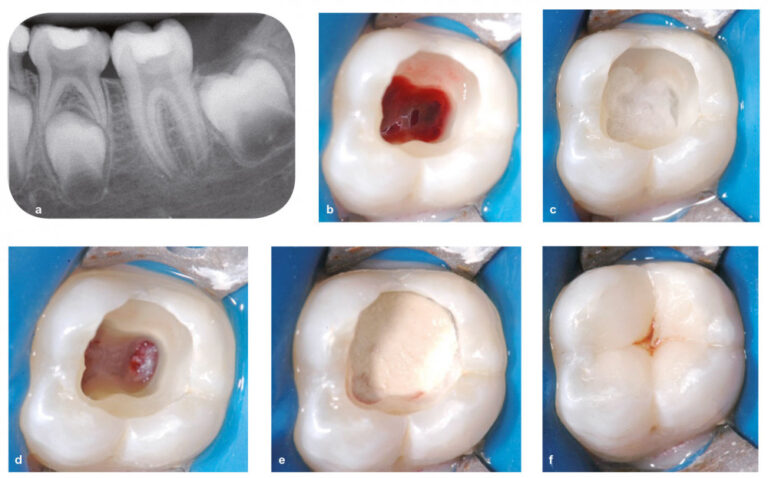
Comme expliqué plus haut, cette procédure peut être indiquée directement après la pose du diagnostic ou de manière plus graduelle, lors de la recherche de l’hémostase. La procédure clinique est similaire à la pulpotomie partielle, à l’exception que la totalité de la masse pulpaire camérale est éliminée, jusqu’aux orifices canalaires, pour assurer l’élimination complète de toute la pulpe inflammatoire. Le tissu pulpaire radiculaire est alors coiffé à l’aide d’un matériau de coiffage (fig. 7a-f).
Cette procédure offre une meilleure chance d’éliminer le tissu enflammé comparé à une pulpotomie partielle.
Par ailleurs, la capacité à contrôler l’hémorragie pulpaire après l’amputation de la pulpe camérale est un complément au diagnostic de l’état inflammatoire pulpaire et de l’évaluation du potentiel réparateur du tissu pulpaire résiduel. L’hémostase est recherchée avec l’application d’une boulette de coton imbibée d’hypochlorite de sodium entre 1 et 2,5 % pendant 2 minutes. Cette étape peut être répétée jusqu’à 6 minutes.
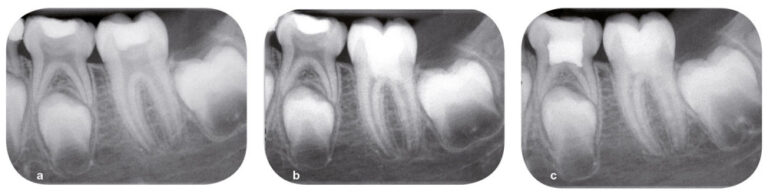
Une fois l’hémostase obtenue, le matériau de coiffage avec une épaisseur minimale (selon les indications du fabricant) est posé sur les orifices canalaires. Après sa prise, le matériau de restauration transitoire ou d’usage peut être mis en place. Si la Biodentine est le matériau de coiffage choisi, elle peut être utilisée également comme matériau de restauration coronaire transitoire, et le suivi est mis en place (fig. 8a-c).
Importance du suivi
Le suivi est indispensable, d’une part pour vérifier la disparition des signes cliniques initiaux, la non-apparition de nouveaux signes cliniques, la formation d’un pont minéralisé, objectivable sur une radiographie après six semaines, et d’autre part pour intercepter les complications pulpaires (présence d’une lésion inflammatoire périradiculaire d’origine endodontique, LIPOE).
L’examen de contrôle comprend les différents tests de palpation, de percussion et de sensibilité (test électrique) et doit avoir lieu après trois semaines, quatre semaines, trois mois, six mois et douze mois, puis une fois par an pendant les quatre premières années.
Les tests de sensibilité peuvent ne pas être probants. En effet, les dents ayant subi une pulpotomie camérale ne répondront pas forcément aux tests de sensibilité pulpaire. Ceci n’indique en aucun cas un échec de la thérapeutique. C’est aussi la raison pour laquelle des radiographies de contrôle doivent être régulièrement réalisées pour la détection de radioclartés apicales. Pour les dents immatures, elles permettent de s’assurer de la poursuite du développement radiculaire.
La présence de sensibilités à quarante-huit heures n’est pas rédhibitoire pour le succès de la thérapeutique. D’ailleurs, une prescription d’anti-inflammatoires non stéroïdiens est recommandée. Toutefois, la présence et la persistance de douleurs intenses à quarante-huit heures objectivent une inflammation pulpaire beaucoup plus intense, avec une inflammation de la pulpe radiculaire, et indiquent un échec « immédiat ». Cet échec est causé par une mauvaise évaluation de l’état inflammatoire pulpaire, qui a probablement été sous-évalué (à condition d’exclure un acte iatrogène ou une contamination peropératoire). En effet, la résolution de l’inflammation fait appel à une balance entre la destruction et la réparation des tissus. Si l’intensité de l’inflammation est très importante, elle va inhiber la réparation et aboutir à la destruction tissulaire. Cet échec de la thérapeutique de préservation de la vitalité pulpaire doit orienter vers la pulpectomie.
Un des intérêts du suivi sur le long terme de ces thérapeutiques est de s’assurer de la non-apparition d’une LIPOE. La survenue d’une telle lésion constitue un échec qu’on qualifierait de « tardif ou retardé », qui serait causé par un manque d’étanchéité du matériau de coiffage et/ou du matériau de restauration coronaire ou une erreur peropératoire.
Pour quel pronostic ?
Le succès est défini comme l’absence de symptômes et de lésions apicales ainsi que le maintien de la vitalité pulpaire.
En cas d’exposition pulpaire liée à une lésion carieuse profonde, le taux de succès du coiffage direct peut être de bon pronostic s’il est mené dans de bonnes conditions. Les taux de succès sont variables selon les études, allant de 80 à 90 % [40,42,51]. Dans l’étude de Marques et coll. en 2015 [40] réalisée sous champ opératoire et sous microscope opératoire sur des dents avec pulpite réversible, un taux de succès de près de 93 % à trois ans a été objectivé. Parmi les facteurs pronostiques mis en évidence, on retrouve l’utilisation d’un champ opératoire, d’aides visuelles, de biomatériaux de la famille des silicates calciques (MTA). Des études utilisant d’autres matériaux comme la Biodentine [52,53] ont également montré un excellent taux de succès.
L’étude de Marques et coll. met en évidence l’influence de l’âge sur le taux de succès du coiffage pulpaire et suggère que les patients de plus de 40 ans ont un moins bon taux de succès que les patients plus jeunes. L’âge de 40 ans a été choisi de façon arbitraire dans cette étude. Cela ne veut pas dire que le coiffage est contre-indiqué chez les patients plus âgés ; cela renseigne sur le fait que le taux de succès attendu sera moins bon. Cela s’explique facilement par la senescence pulpaire et un volume pulpaire réduit, et donc des cellules pulpaires disponibles en nombre réduit [54].
Lorsqu’on parle de l’âge comme facteur pronostique, il s’agit surtout de l’âge pulpaire. Les années passant, les modifications de la pulpe diminuent ses capacités de réparation ; le potentiel de différenciation des cellules progénitrices se voit notamment réduit. Plus la pulpe a été agressée par le passé et plus elle vieillit histologiquement [55]. L’étude de Marques est très intéressante car elle met en lumière un autre facteur pronostique : le site de la lésion carieuse. En effet, dans cette étude prospective, il est observé que lorsqu’il s’agit de lésions occlusales, le taux de succès est de 100 % et lorsque la lésion intéresse les zones proximales, le taux de succès est de 89,7 % [38-39].
L’étude princeps de Simon et coll., en 2013, a montré pour la première fois un taux de succès élevé de 82 % à deux ans de la pulpotomie camérale comme traitement d’usage pour les dents présentant une pulpite réversible [56].
Que faire en cas de pulpite irréversible ?
Les résultats présentés par les auteurs montrent que la conservation de la vitalité pulpaire, malgré le diagnostic de pulpite irréversible chez l’adulte, est possible. En effet, dans cette étude clinique randomisée jordanienne de 2017, Taha et coll. montrent un taux de succès de 85 % après la réalisation d’une pulpotomie partielle avec le biomatériau MTA [57]. Lorsque l’hydroxyde de calcium est utilisé comme matériau de coiffage, le taux de succès chute à 43 % sur deux ans.
Il a également été montré que la mise en œuvre de la pulpotomie camérale sur des dents avec une pulpite irréversible permet de préserver la vitalité de la pulpe radiculaire, et ainsi les fonctions pulpaires. Une étude clinique observationnelle de Taha et coll. a montré un taux de succès de 97,7 % à un an et de 92,7 % à trois ans [58]. Par ailleurs, une étude clinique randomisée évaluant le taux de succès de la pulpotomie partielle utilisant ProRoot MTA et la Biodentine dans le cadre de pulpite irréversible sur dents permanentes a montré que cette thérapeutique est prometteuse et garante de succès [59].
Répondre à la question « entre la pulpotomie et la pulpectomie, quelle est la meilleure thérapeutique pour traiter les dents avec pulpite irréversible ? »
Pour se prononcer, il faudrait une étude clinique randomisée comparant les deux thérapeutiques. C’est l’objectif de l’étude clinique Pulpsave du Pr Stéphane Simon [60], qui cherche à montrer la non-infériorité de la pulpotomie face à la pulpectomie. Cette étude multicentrique randomisée débutée il y a deux ans devrait apporter des réponses claires à la question que tous les cliniciens se posent dans leur pratique clinique quotidienne.
En attendant les résultats de cette étude, il semble, avec toutes les données scientifiques et cliniques actuellement disponibles, que nos thérapeutiques doivent tendre vers la préservation de la vitalité pulpaire. Ces dernières doivent être mises en œuvre à chaque fois que cela est possible, après information et consentement du patient. Si un échec survient, alors un traitement endodontique pourra être mis en œuvre.
Conclusion
Préserver la vitalité pulpaire et promouvoir les stratégies thérapeutiques fondées sur la biologie pulpaire représente le fer de lance de la gestion des caries profondes. En premier lieu, les stratégies de curetage sélectif doivent être mises en œuvre pour éviter l’exposition pulpaire.
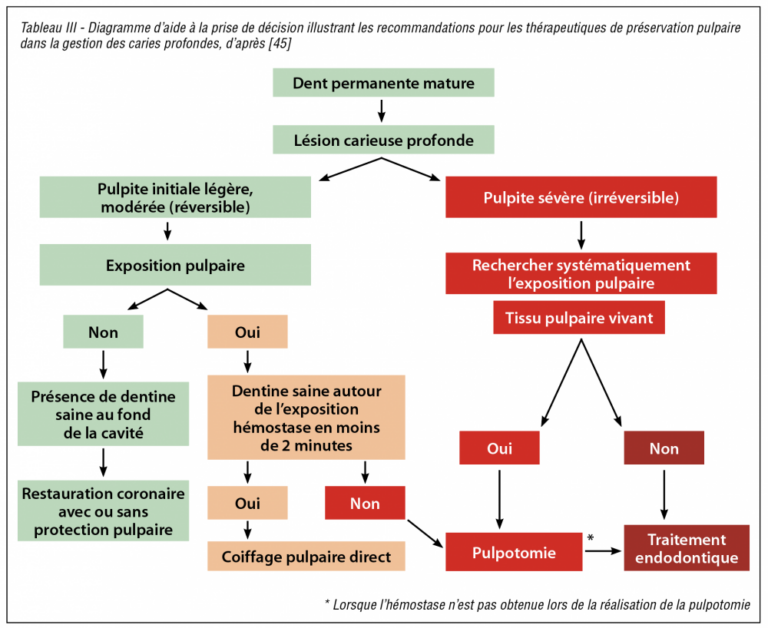
Pour des cas cliniques avec présence d’une symptomatologie pulpaire, le curetage sera complet et l’effraction pulpaire recherchée. Une thérapeutique de préservation de la vitalité pulpaire sera mise en œuvre dans les conditions favorables indispensables à son succès (tabl. III).
Vous avez aimé cet article ?
Approfondissez la thématique en suivant la formation du Dr Alexis GAUDIN : Endodontie pratique
Bibliographie
- Asgary S, Fazlyab M, Sabbagh S, Eghbal MJ. Outcomes of different vital pulp therapy techniques on symptomatic permanent teeth: a case series, Iran Endod J. 2014 Fall;9(4);295-300.
- Kakehashi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol. 1965 Sep;20:340-9.
- European Society of Endodontology (ESE), Duncan HF, Galler KM, Tomson PL, Simon S, El-Karim I et al. European Society of Endodontology position statement: management of deep caries and the exposed pulp. Int Endod J. 2019 Jul;52(7) :923-34.
- Cooper PR, Takahashi Y, Graham LW, Simon S, Imazato S, Smith AJ. Inflammation-regeneration interplay in the dentine-pulp complex. J Dent. 2010 Sep;38(9):687-97.
- Farges JC, Keller JF, Carrouel F, Durand SH, Romeas A, Bleicher F et al. Odontoblasts in the dental pulp immune response. J Exp Zool Mol Dev Evol. 2009 Jul 15;312B(5):425-36.
- Farges JC, Alliot-Licht B, Renard E, Ducret M, Gaudin A, Smith AJ et al. Dental pulp defense and repair mechanisms in dental caries. Mediators Inflamm. 2015;2015:230251.
- Soden RI, Botero TM, Hanks CT, Nör JE. Angiogenic signaling triggered by cariogenic bacteria in pulp cells. J Dent Res. 2009 Sep;88(9):835-40.
- Couve E, Osorio R, Schmachtenberg O. The amazing odontoblast: activity, autophagy, and aging. J Dent Res. 2013 Sep;92(9):765-72.
- Bjørndal L, Mjör IA. Pulp-dentin biology in restorative dentistry. Part 4: dental caries characteristics of lesions and pulpal reactions. Quintessence Int. 2001 Oct;32(9):717-36.
- Mjör IA. Pulp-dentin biology in restorative dentistry. Part 7: the exposed pulp. Quintessence Int. 2002 Feb;33(2):113-35.
- Smith AJ, Cassidy N, Perry H, Begue-Kirn C, Ruch JV, Lesot H. Reactionary dentinogenesis. Int J Dev Biol. 2003 Feb 1;39(1):273 80.
- Fitzgerald M. Cellular mechanics of dentinal bridge repair using 3H-Thymidine. J Dent Res. 1979 Nov;58(Spec Issue D):2198 206.
- Fitzgerald M, Chiego DJ, Heys DR. Autoradiographic analysis of odontoblast replacement following pulp exposure in primate teeth. Arch Oral Biol. 1990;35(9):707 15.
- Carlile MJ, Sturrock MG, Chisholm DM, Ogden GR, Schor AM. The presence of pericytes and transitional cells in the vasculature of the human dental pulp: an ultrastructural study. Histochem J. 2000 Apr;32(4):239 45.
- Alliot-Licht B, Hurtrel D, Gregoire M. Characterization of alpha-smooth muscle actin positive cells in mineralized human dental pulp cultures. Arch Oral Biol. 2001 Mar;46(3):221 8.
- Goldberg M, Smith AJ. Cells and extracellular matrices of dentin and pulp: a biological basis for repair and tissue engineering. Crit Rev Oral Biol Med. 2004 Jan 1;15(1):13 27.
- Smith AJ. Vitality of the dentin-pulp complex in health and disease: growth factors as key mediators. J Dent Educ. 2003 Jun;67(6):678–89.
- Graham L, Cooper PR, Cassidy N, Nor JE, Sloan AJ, Smith AJ. The effect of calcium hydroxide on solubilisation of bio-active dentine matrix components. Biomaterials. 2006 May;27(14):2865-73.
- Tomson PL, Grover LM, Lumley PJ, Sloan AJ, Smith AJ, Cooper PR. Dissolution of bio-active dentine matrix components by mineral trioxide aggregate. J Dent. 2007 Aug;35(8):636-42.
- Tran XV, Gorin C, Willig C, Baroukh B, Pellat B, Decup F et al. Effect of a calcium-silicate-based restorative cement on pulp repair. J Dent Res. 2012 Dec;91(12):1166 71.
- Min K-S, Yang S-H, Kim E-C. The combined effect of mineral trioxide aggregate and enamel matrix derivative on odontoblastic differentiation in human dental pulp cells. J Endod. 2009;35(6):847 51.
- Kuratate M, Yoshiba K, Shigetani Y, Yoshiba N, Ohshima H, Okiji T. Immunohistochemical analysis of nestin, osteopontin, and proliferating cells in the reparative process of exposed dental pulp capped with mineral trioxide aggregate. J Endod. 2008 Aug;34(8):970 4.
- Holland R, de Souza V, Murata SS, Nery MJ, Bernabé PFE, Filho JAO, et al. Healing process of dog dental pulp after pulpotomy and pulp covering with mineral trioxide aggregate or portland cement. Braz Dent J. 2001;5.
- Bortoluzzi EA, Broon NJ, Bramante CM, Felippe WT, Tanomaru Filho M, Esberard RM. the influence of calcium chloride on the setting time, solubility, disintegration, and ph of mineral trioxide aggregate and white portland cement with a radiopacifier. J Endod. 2009 Apr;35(4):550 4.
- Pradelle-Plasse N, Tran XV, Colon P. Physico-chemical properties of BiodentineTM. In: Goldberg M. (dir). Biocompatibility or cytotoxic effects of dental composites. Oxford : Coxmoor; 2009, 184-94.
- Villat C, Tran XV, Pradelle-Plasse N, Ponthiaux P, Wenger F, Grosgogeat B et al. Impedance methodology: a new way to characterize the setting reaction of dental cements. Dent Mater. 2010 Dec;26(12):1127-32.
- Laurent P, Camps J, De Méo M, Déjou J, About I. Induction of specific cell responses to a Ca3SiO5-based posterior restorative material. Dent Mater. 2008;24(11):1486 94.
- Zanini M, Sautier JM, Berdal A, Simon S. Biodentine induces immortalized murine pulp cell differentiation into odontoblast-like cells and stimulates biomineralization. J Endod. 2012 Sep;38(9):1220-6.
- Daltoé MO, Wanderley F, G. Paula-Silva. Expression of mineralization markers during pulp response to Biodentine an mineral trioxide aggregate. J Endod. 2016 Apr;42(4):596-603.
- Kim J, Song Y-S, Min K-S, Kim S-H, Koh J-T, Lee B-N et al. Evaluation of reparative dentin formation of ProRoot MTA, Biodentine and BioAggregate using micro-CT and immunohistochemistry. Restor Dent Endod. 2016;41(1):29 36.
- Giraud T, Jeanneau C, Rombouts C, Bakhtiar H, Laurent P, About I. Pulp capping materials modulate the balance between inflammation and regeneration. Dent Mater. 2019 Jan;35(1):24-35.
- Weisleder R, Yamauchi S, Caplan DJ, Trope M, Teixeira FB. The vitality of pulp testing: a clinical study. J Am Dent Assoc 2009:140(8):1013-17.
- Mejàre IA, Axelsson S, Davidson T, Frisk F, Hakeberg M, Kvist T et al. Diagnosis of the condition of the dental pulp: a systematic review. Int Endod J. 2012 Jul;45(7):597-613.
- Dummer PM, Hicks R, Huws D. Clinical signs and symptoms in pulp disease. Int Endod J. 1980 Jan;13(1):27-35.35.
- Ricucci D, Loghin S, Siqueira JF. correlation between clinical and histologic pulp diagnoses. J Endod. 2014;40(12):1932 9.
- Wolters WJ, Duncan HF, Tomson PL, Karim IE, McKenna G, Dorri M et al. Minimally invasive endodontics: a new diagnostic system for assessing pulpitis and subsequent treatment needs. nt Endod J. 2017 Sep;50(9):825-9.
- El Salhy M, Azizieh F, Raghupathy R. Cytokines as diagnostic markers of pulpal inflammation. Int Endod J. 2013;46(6):573 80.
- Mente J, Perovic J, Gebrig H, Rampf S, Michel A, Schürz A et al. A prospective clinical pilot study on the level of matrix metalloproteinase – 9 in dental blood as a marker for the state of inflammation in the pulp tissue. J Endod. 2016 Feb;42(2):190-7.
- Bogen G, Kim JS, Bakland LK. Direct pulp capping with mineral trioxide aggregate: an observational study. J Am Dent Assoc. 2008;139:305-15.
- Marques MS et al. Outcome of direct pulp capping with mineral trioxide aggregate: A prospective study. J Endod. 2015;41(7):1026.
- Mente J, Hufnagel S, Leo M, et al. Treatment outcome of mineral trioxide aggregate or calcium hydroxide direct pulp capping: long-term results. J Endod. 2014;40:1746-51.
- Kundzina R, Stangvaltaite L, Eriksen HM, Kerosuo E. Capping carious exposures in adults: a randomized controlled trial investigating mineral trioxide aggregate versus calcium hydroxide. Int Endod J. 2017;50:924-32.
- Tirlet G, Attal JP. Le gradient thérapeutique : un concept médical pour les traitements esthétiques. Inf Dent. 2009 Nov.41/42(25):2561-8.
- Granath LE, Hagman G. Experimental pulpotomy in human bicuspids with reference to cutting technique. Acta Odontol Scand. 1971 Jun;29(2):155-63.
- Ricucci D, Siqueira JF Jr, Li Y, Tay FR. Vital pulp therapy: histopathology and histobacteriology-based guidelines to treat teeth with deep caries and pulp exposure. J Dent. 2019 Jul;86:41-52.
- Hashem DF, Foxton R, Manoharan A, Watson TF, Banerjee A. The physical characteristics of resin composite–calcium silicate interface as part of a layered/laminate adhesive restoration. Dent Mater 2014;30:343-9.
- Cenzig E., Ulusoy N. microshear bond strength of tri-calcium silicate-based cements to different restorative materials. J Adhes Dent 2016:231-7.
- Mejàre I, Cvek M. Partial pulpotomy in young permanent teeth with deep carious lesions. Endod Dent Traumatol. 1993 Dec;9(6):238-42.
- Barrieshi-Nusair KM, Qudeimat MA. A prospective clinical study of mineral trioxide aggregate for partial pulpotomy in cariously exposed permanent teeth. J Endod. 2006;32:731-5.
- Chailertvanitkul P, Paphangkorakit J, Sooksantisakoonchai N, Pumas N, Pairojamornyoot W et al. Randomized control trial comparing calcium hydroxide and mineral trioxide aggregate for partial pulpotomies in cariously exposed pulps of permanent molars. Int Endod J. 2014 Sep;47(9):835-42.
- Hilton TJ, Ferracane JL, Mancl L, Northwest Practice-based Research Collaborative in Evidence-based Dentistry (NWP). Comparison of CaOH with MTA for direct pulp capping: a PBRN randomized clinical trial. J Dent Res. 2013 Jul.92(7 Suppl):16S-22S.
- Nowicka A, Lipski M, Parafiniuk M, Sporniak-Tutak K, Lichota D, Kosierkiewicz A et al. Response of human dental pulp capped with Biodentine and mineral trioxide aggregate. J Endod. 2013 Jun;39(6):743-7.
- Nowicka A, Wilk G, Lipski M, Kołecki J, Buczkowska-Radlińska J. tomographic evaluation of reparative dentin formation after direct pulp capping with Ca(OH)2, MTA, Biodentine, and dentin bonding system in human teeth. J Endod. 2015 Aug;41(8):1234-40.
- Goodis HE, Kahn A, Simon S. Aging and the pulp. In: Hargreaves KM, Goodis HE, Tay FR. Dental pulp Seltzer and Bender’s. Quintessence; 2012, pp. 421-46.
- Bence R. Handbook of clinical endodontics (2nd ed) St Louis: Mosby; 1980, 282 p.
- Simon S, Perard M, Zanini M, Smith AJ, Charpentier E, Djole SX et al. Should pulp chamber pulpotomy be seen as a permanent treatment? Some preliminary thoughts. Int Endod J. 2013 Jan;46(1):79-87.
- Taha NA, Khazali MA. Partial pulpotomy in mature permanent teeth with clinical signs indicative of irreversible pulpitis: a randomized clinical trial. J Endod. 2017 Sep;43(9):1417-21.
- Taha NA, Abdelkhader SZ. Outcome of full pulpotomy using Biodentine in adult patients with symptoms indicative of irreversible pulpitis. Int Endod J. 2018 Aug;51(8):819-28.
- Uesrichai N, Nirunsittirat A, Chuveera P, Srisuwan T, Sastraruji T, Chompu-Inwai P. Partial pulpotomy with two bioactive cements in permanent teeth of 6- to 18-year-old patients with signs and symptoms indicative of irreversible pulpitis: a noninferiority randomized controlled trial. Int Endod J. 2019 Jun;52(6):749-759.
- Projet hospitalier de recherche clinique coordonné par le Pr Stéphane Simon. [En ligne] https://pulpsave.weebly.com. Consulté le 17 septembre 2019
Si le degré d’inflammation pulpaire a été sous-évalué, la pulpe est plus hémorragique, du fait de la congestion pulpaire, et l’hémostase sera longue à obtenir, ce qui est préjudiciable pour le pronostic de la pulpotomie partielle. La pulpotomie complète doit alors être préférée.
Pulpotomie complète
Comme expliqué plus haut, cette procédure peut être indiquée directement après la pose du diagnostic ou de manière plus graduelle, lors de la recherche de l’hémostase. La procédure clinique est similaire à la pulpotomie partielle, à l’exception que la totalité de la masse pulpaire camérale est éliminée, jusqu’aux orifices canalaires, pour assurer l’élimination complète de toute la pulpe inflammatoire. Le tissu pulpaire radiculaire est alors coiffé à l’aide d’un matériau de coiffage (fig. 7a-f).

Fig. 7 – Pulpotomie camérale. Patiente de 9 ans présentant une pulpite sévère irréversible au niveau de la 36 (a). L’édification radiculaire est non terminée. Il a été décidé de mettre en œuvre une pulpotomie camérale. Après élimination de l’ancienne restauration et éviction de la dentine cariée, l’effraction pulpaire a été réalisée. Le plafond pulpaire a été éliminé ; la pulpe camérale est bien vitale et inflammatoire (b). La cavité est désinfectée et l’hémostase est recherchée à l’aide d’une boulette de coton imprégnée d’hypochlorite à 1 % (c). L’hémostase est objectivable au niveau de tous les orifices canalaires (d). Le matériau de coiffage est ensuite appliqué sur les orifices et dans la chambre pulpaire. Ici, le biomatériau Biodentine a été utilisé (e). Après la prise du biomatériau (12 minutes), dans la même séance, la restauration d’usage en résine composite a été réalisée (f). Une prescription d’antalgique (prise systématique, et non en cas de douleur, pendant 48 heures) a été faite à la fin de la séance.
Cette procédure offre une meilleure chance d’éliminer le tissu enflammé comparé à une pulpotomie partielle.
Par ailleurs, la capacité à contrôler l’hémorragie pulpaire après l’amputation de la pulpe camérale est un complément au diagnostic de l’état inflammatoire pulpaire et de l’évaluation du potentiel réparateur du tissu pulpaire résiduel. L’hémostase est recherchée avec l’application d’une boulette de coton imbibée d’hypochlorite de sodium entre 1 et 2,5 % pendant 2 minutes. Cette étape peut être répétée jusqu’à 6 minutes.
Une fois l’hémostase obtenue, le matériau de coiffage avec une épaisseur minimale (selon les indications du fabricant) est posé sur les orifices canalaires. Après sa prise, le matériau de restauration transitoire ou d’usage peut être mis en place. Si la Biodentine est le matériau de coiffage choisi, elle peut être utilisée également comme matériau de restauration coronaire transitoire, et le suivi est mis en place (fig. 8a-c).

Fig. 8 – Un suivi clinique et radiographique est mis en place. La douleur a disparu dans les soixante-douze heures après la thérapeutique : radiographie préopératoire (a), radiographie postopératoire immédiate (b), radiographie après six mois (c). On objective la poursuite de l’édification radiculaire et la fermeture apicale. (Courtoisie du Dr François Bronnec)
Importance du suivi
Le suivi est indispensable, d’une part pour vérifier la disparition des signes cliniques initiaux, la non-apparition de nouveaux signes cliniques, la formation d’un pont minéralisé, objectivable sur une radiographie après six semaines, et d’autre part pour intercepter les complications pulpaires (présence d’une lésion inflammatoire périradiculaire d’origine endodontique, LIPOE).
L’examen de contrôle comprend les différents tests de palpation, de percussion et de sensibilité (test électrique) et doit avoir lieu après trois semaines, quatre semaines, trois mois, six mois et douze mois, puis une fois par an pendant les quatre premières années.
Les tests de sensibilité peuvent ne pas être probants. En effet, les dents ayant subi une pulpotomie camérale ne répondront pas forcément aux tests de sensibilité pulpaire. Ceci n’indique en aucun cas un échec de la thérapeutique. C’est aussi la raison pour laquelle des radiographies de contrôle doivent être régulièrement réalisées pour la détection de radioclartés apicales. Pour les dents immatures, elles permettent de s’assurer de la poursuite du développement radiculaire.
La présence de sensibilités à quarante-huit heures n’est pas rédhibitoire pour le succès de la thérapeutique. D’ailleurs, une prescription d’anti-inflammatoires non stéroïdiens est recommandée. Toutefois, la présence et la persistance de douleurs intenses à quarante-huit heures objectivent une inflammation pulpaire beaucoup plus intense, avec une inflammation de la pulpe radiculaire, et indiquent un échec « immédiat ». Cet échec est causé par une mauvaise évaluation de l’état inflammatoire pulpaire, qui a probablement été sous-évalué (à condition d’exclure un acte iatrogène ou une contamination peropératoire). En effet, la résolution de l’inflammation fait appel à une balance entre la destruction et la réparation des tissus. Si l’intensité de l’inflammation est très importante, elle va inhiber la réparation et aboutir à la destruction tissulaire. Cet échec de la thérapeutique de préservation de la vitalité pulpaire doit orienter vers la pulpectomie.
Un des intérêts du suivi sur le long terme de ces thérapeutiques est de s’assurer de la non-apparition d’une LIPOE. La survenue d’une telle lésion constitue un échec qu’on qualifierait de « tardif ou retardé », qui serait causé par un manque d’étanchéité du matériau de coiffage et/ou du matériau de restauration coronaire ou une erreur peropératoire.
Pour quel pronostic ?
Le succès est défini comme l’absence de symptômes et de lésions apicales ainsi que le maintien de la vitalité pulpaire.
En cas d’exposition pulpaire liée à une lésion carieuse profonde, le taux de succès du coiffage direct peut être de bon pronostic s’il est mené dans de bonnes conditions. Les taux de succès sont variables selon les études, allant de 80 à 90 % [40,42,51]. Dans l’étude de Marques et coll. en 2015 [40] réalisée sous champ opératoire et sous microscope opératoire sur des dents avec pulpite réversible, un taux de succès de près de 93 % à trois ans a été objectivé. Parmi les facteurs pronostiques mis en évidence, on retrouve l’utilisation d’un champ opératoire, d’aides visuelles, de biomatériaux de la famille des silicates calciques (MTA). Des études utilisant d’autres matériaux comme la Biodentine [52,53] ont également montré un excellent taux de succès.
L’étude de Marques et coll. met en évidence l’influence de l’âge sur le taux de succès du coiffage pulpaire et suggère que les patients de plus de 40 ans ont un moins bon taux de succès que les patients plus jeunes. L’âge de 40 ans a été choisi de façon arbitraire dans cette étude. Cela ne veut pas dire que le coiffage est contre-indiqué chez les patients plus âgés ; cela renseigne sur le fait que le taux de succès attendu sera moins bon. Cela s’explique facilement par la senescence pulpaire et un volume pulpaire réduit, et donc des cellules pulpaires disponibles en nombre réduit [54].
Lorsqu’on parle de l’âge comme facteur pronostique, il s’agit surtout de l’âge pulpaire. Les années passant, les modifications de la pulpe diminuent ses capacités de réparation ; le potentiel de différenciation des cellules progénitrices se voit notamment réduit. Plus la pulpe a été agressée par le passé et plus elle vieillit histologiquement [55]. L’étude de Marques est très intéressante car elle met en lumière un autre facteur pronostique : le site de la lésion carieuse. En effet, dans cette étude prospective, il est observé que lorsqu’il s’agit de lésions occlusales, le taux de succès est de 100 % et lorsque la lésion intéresse les zones proximales, le taux de succès est de 89,7 % [38-39].
L’étude princeps de Simon et coll., en 2013, a montré pour la première fois un taux de succès élevé de 82 % à deux ans de la pulpotomie camérale comme traitement d’usage pour les dents présentant une pulpite réversible [56].
Que faire en cas de pulpite irréversible ?
Les résultats présentés par les auteurs montrent que la conservation de la vitalité pulpaire, malgré le diagnostic de pulpite irréversible chez l’adulte, est possible. En effet, dans cette étude clinique randomisée jordanienne de 2017, Taha et coll. montrent un taux de succès de 85 % après la réalisation d’une pulpotomie partielle avec le biomatériau MTA [57]. Lorsque l’hydroxyde de calcium est utilisé comme matériau de coiffage, le taux de succès chute à 43 % sur deux ans.
Il a également été montré que la mise en œuvre de la pulpotomie camérale sur des dents avec une pulpite irréversible permet de préserver la vitalité de la pulpe radiculaire, et ainsi les fonctions pulpaires. Une étude clinique observationnelle de Taha et coll. a montré un taux de succès de 97,7 % à un an et de 92,7 % à trois ans [58]. Par ailleurs, une étude clinique randomisée évaluant le taux de succès de la pulpotomie partielle utilisant ProRoot MTA et la Biodentine dans le cadre de pulpite irréversible sur dents permanentes a montré que cette thérapeutique est prometteuse et garante de succès [59].
Répondre à la question « entre la pulpotomie et la pulpectomie, quelle est la meilleure thérapeutique pour traiter les dents avec pulpite irréversible ? »
Pour se prononcer, il faudrait une étude clinique randomisée comparant les deux thérapeutiques. C’est l’objectif de l’étude clinique Pulpsave du Pr Stéphane Simon [60], qui cherche à montrer la non-infériorité de la pulpotomie face à la pulpectomie. Cette étude multicentrique randomisée débutée il y a deux ans devrait apporter des réponses claires à la question que tous les cliniciens se posent dans leur pratique clinique quotidienne.
En attendant les résultats de cette étude, il semble, avec toutes les données scientifiques et cliniques actuellement disponibles, que nos thérapeutiques doivent tendre vers la préservation de la vitalité pulpaire. Ces dernières doivent être mises en œuvre à chaque fois que cela est possible, après information et consentement du patient. Si un échec survient, alors un traitement endodontique pourra être mis en œuvre.
Conclusion
Préserver la vitalité pulpaire et promouvoir les stratégies thérapeutiques fondées sur la biologie pulpaire représente le fer de lance de la gestion des caries profondes. En premier lieu, les stratégies de curetage sélectif doivent être mises en œuvre pour éviter l’exposition pulpaire.
Pour des cas cliniques avec présence d’une symptomatologie pulpaire, le curetage sera complet et l’effraction pulpaire recherchée. Une thérapeutique de préservation de la vitalité pulpaire sera mise en œuvre dans les conditions favorables indispensables à son succès (tabl. III).

Vous avez aimé cet article ?
Approfondissez la thématique en suivant la formation du Dr Alexis GAUDIN : Endodontie pratique
Bibliographie
- Asgary S, Fazlyab M, Sabbagh S, Eghbal MJ. Outcomes of different vital pulp therapy techniques on symptomatic permanent teeth: a case series, Iran Endod J. 2014 Fall;9(4);295-300.
- Kakehashi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol. 1965 Sep;20:340-9.
- European Society of Endodontology (ESE), Duncan HF, Galler KM, Tomson PL, Simon S, El-Karim I et al. European Society of Endodontology position statement: management of deep caries and the exposed pulp. Int Endod J. 2019 Jul;52(7) :923-34.
- Cooper PR, Takahashi Y, Graham LW, Simon S, Imazato S, Smith AJ. Inflammation-regeneration interplay in the dentine-pulp complex. J Dent. 2010 Sep;38(9):687-97.
- Farges JC, Keller JF, Carrouel F, Durand SH, Romeas A, Bleicher F et al. Odontoblasts in the dental pulp immune response. J Exp Zool Mol Dev Evol. 2009 Jul 15;312B(5):425-36.
- Farges JC, Alliot-Licht B, Renard E, Ducret M, Gaudin A, Smith AJ et al. Dental pulp defense and repair mechanisms in dental caries. Mediators Inflamm. 2015;2015:230251.
- Soden RI, Botero TM, Hanks CT, Nör JE. Angiogenic signaling triggered by cariogenic bacteria in pulp cells. J Dent Res. 2009 Sep;88(9):835-40.
- Couve E, Osorio R, Schmachtenberg O. The amazing odontoblast: activity, autophagy, and aging. J Dent Res. 2013 Sep;92(9):765-72.
- Bjørndal L, Mjör IA. Pulp-dentin biology in restorative dentistry. Part 4: dental caries characteristics of lesions and pulpal reactions. Quintessence Int. 2001 Oct;32(9):717-36.
- Mjör IA. Pulp-dentin biology in restorative dentistry. Part 7: the exposed pulp. Quintessence Int. 2002 Feb;33(2):113-35.
- Smith AJ, Cassidy N, Perry H, Begue-Kirn C, Ruch JV, Lesot H. Reactionary dentinogenesis. Int J Dev Biol. 2003 Feb 1;39(1):273 80.
- Fitzgerald M. Cellular mechanics of dentinal bridge repair using 3H-Thymidine. J Dent Res. 1979 Nov;58(Spec Issue D):2198 206.
- Fitzgerald M, Chiego DJ, Heys DR. Autoradiographic analysis of odontoblast replacement following pulp exposure in primate teeth. Arch Oral Biol. 1990;35(9):707 15.
- Carlile MJ, Sturrock MG, Chisholm DM, Ogden GR, Schor AM. The presence of pericytes and transitional cells in the vasculature of the human dental pulp: an ultrastructural study. Histochem J. 2000 Apr;32(4):239 45.
- Alliot-Licht B, Hurtrel D, Gregoire M. Characterization of alpha-smooth muscle actin positive cells in mineralized human dental pulp cultures. Arch Oral Biol. 2001 Mar;46(3):221 8.
- Goldberg M, Smith AJ. Cells and extracellular matrices of dentin and pulp: a biological basis for repair and tissue engineering. Crit Rev Oral Biol Med. 2004 Jan 1;15(1):13 27.
- Smith AJ. Vitality of the dentin-pulp complex in health and disease: growth factors as key mediators. J Dent Educ. 2003 Jun;67(6):678–89.
- Graham L, Cooper PR, Cassidy N, Nor JE, Sloan AJ, Smith AJ. The effect of calcium hydroxide on solubilisation of bio-active dentine matrix components. Biomaterials. 2006 May;27(14):2865-73.
- Tomson PL, Grover LM, Lumley PJ, Sloan AJ, Smith AJ, Cooper PR. Dissolution of bio-active dentine matrix components by mineral trioxide aggregate. J Dent. 2007 Aug;35(8):636-42.
- Tran XV, Gorin C, Willig C, Baroukh B, Pellat B, Decup F et al. Effect of a calcium-silicate-based restorative cement on pulp repair. J Dent Res. 2012 Dec;91(12):1166 71.
- Min K-S, Yang S-H, Kim E-C. The combined effect of mineral trioxide aggregate and enamel matrix derivative on odontoblastic differentiation in human dental pulp cells. J Endod. 2009;35(6):847 51.
- Kuratate M, Yoshiba K, Shigetani Y, Yoshiba N, Ohshima H, Okiji T. Immunohistochemical analysis of nestin, osteopontin, and proliferating cells in the reparative process of exposed dental pulp capped with mineral trioxide aggregate. J Endod. 2008 Aug;34(8):970 4.
- Holland R, de Souza V, Murata SS, Nery MJ, Bernabé PFE, Filho JAO, et al. Healing process of dog dental pulp after pulpotomy and pulp covering with mineral trioxide aggregate or portland cement. Braz Dent J. 2001;5.
- Bortoluzzi EA, Broon NJ, Bramante CM, Felippe WT, Tanomaru Filho M, Esberard RM. the influence of calcium chloride on the setting time, solubility, disintegration, and ph of mineral trioxide aggregate and white portland cement with a radiopacifier. J Endod. 2009 Apr;35(4):550 4.
- Pradelle-Plasse N, Tran XV, Colon P. Physico-chemical properties of BiodentineTM. In: Goldberg M. (dir). Biocompatibility or cytotoxic effects of dental composites. Oxford : Coxmoor; 2009, 184-94.
- Villat C, Tran XV, Pradelle-Plasse N, Ponthiaux P, Wenger F, Grosgogeat B et al. Impedance methodology: a new way to characterize the setting reaction of dental cements. Dent Mater. 2010 Dec;26(12):1127-32.
- Laurent P, Camps J, De Méo M, Déjou J, About I. Induction of specific cell responses to a Ca3SiO5-based posterior restorative material. Dent Mater. 2008;24(11):1486 94.
- Zanini M, Sautier JM, Berdal A, Simon S. Biodentine induces immortalized murine pulp cell differentiation into odontoblast-like cells and stimulates biomineralization. J Endod. 2012 Sep;38(9):1220-6.
- Daltoé MO, Wanderley F, G. Paula-Silva. Expression of mineralization markers during pulp response to Biodentine an mineral trioxide aggregate. J Endod. 2016 Apr;42(4):596-603.
- Kim J, Song Y-S, Min K-S, Kim S-H, Koh J-T, Lee B-N et al. Evaluation of reparative dentin formation of ProRoot MTA, Biodentine and BioAggregate using micro-CT and immunohistochemistry. Restor Dent Endod. 2016;41(1):29 36.
- Giraud T, Jeanneau C, Rombouts C, Bakhtiar H, Laurent P, About I. Pulp capping materials modulate the balance between inflammation and regeneration. Dent Mater. 2019 Jan;35(1):24-35.
- Weisleder R, Yamauchi S, Caplan DJ, Trope M, Teixeira FB. The vitality of pulp testing: a clinical study. J Am Dent Assoc 2009:140(8):1013-17.
- Mejàre IA, Axelsson S, Davidson T, Frisk F, Hakeberg M, Kvist T et al. Diagnosis of the condition of the dental pulp: a systematic review. Int Endod J. 2012 Jul;45(7):597-613.
- Dummer PM, Hicks R, Huws D. Clinical signs and symptoms in pulp disease. Int Endod J. 1980 Jan;13(1):27-35.35.
- Ricucci D, Loghin S, Siqueira JF. correlation between clinical and histologic pulp diagnoses. J Endod. 2014;40(12):1932 9.
- Wolters WJ, Duncan HF, Tomson PL, Karim IE, McKenna G, Dorri M et al. Minimally invasive endodontics: a new diagnostic system for assessing pulpitis and subsequent treatment needs. nt Endod J. 2017 Sep;50(9):825-9.
- El Salhy M, Azizieh F, Raghupathy R. Cytokines as diagnostic markers of pulpal inflammation. Int Endod J. 2013;46(6):573 80.
- Mente J, Perovic J, Gebrig H, Rampf S, Michel A, Schürz A et al. A prospective clinical pilot study on the level of matrix metalloproteinase – 9 in dental blood as a marker for the state of inflammation in the pulp tissue. J Endod. 2016 Feb;42(2):190-7.
- Bogen G, Kim JS, Bakland LK. Direct pulp capping with mineral trioxide aggregate: an observational study. J Am Dent Assoc. 2008;139:305-15.
- Marques MS et al. Outcome of direct pulp capping with mineral trioxide aggregate: A prospective study. J Endod. 2015;41(7):1026.
- Mente J, Hufnagel S, Leo M, et al. Treatment outcome of mineral trioxide aggregate or calcium hydroxide direct pulp capping: long-term results. J Endod. 2014;40:1746-51.
- Kundzina R, Stangvaltaite L, Eriksen HM, Kerosuo E. Capping carious exposures in adults: a randomized controlled trial investigating mineral trioxide aggregate versus calcium hydroxide. Int Endod J. 2017;50:924-32.
- Tirlet G, Attal JP. Le gradient thérapeutique : un concept médical pour les traitements esthétiques. Inf Dent. 2009 Nov.41/42(25):2561-8.
- Granath LE, Hagman G. Experimental pulpotomy in human bicuspids with reference to cutting technique. Acta Odontol Scand. 1971 Jun;29(2):155-63.
- Ricucci D, Siqueira JF Jr, Li Y, Tay FR. Vital pulp therapy: histopathology and histobacteriology-based guidelines to treat teeth with deep caries and pulp exposure. J Dent. 2019 Jul;86:41-52.
- Hashem DF, Foxton R, Manoharan A, Watson TF, Banerjee A. The physical characteristics of resin composite–calcium silicate interface as part of a layered/laminate adhesive restoration. Dent Mater 2014;30:343-9.
- Cenzig E., Ulusoy N. microshear bond strength of tri-calcium silicate-based cements to different restorative materials. J Adhes Dent 2016:231-7.
- Mejàre I, Cvek M. Partial pulpotomy in young permanent teeth with deep carious lesions. Endod Dent Traumatol. 1993 Dec;9(6):238-42.
- Barrieshi-Nusair KM, Qudeimat MA. A prospective clinical study of mineral trioxide aggregate for partial pulpotomy in cariously exposed permanent teeth. J Endod. 2006;32:731-5.
- Chailertvanitkul P, Paphangkorakit J, Sooksantisakoonchai N, Pumas N, Pairojamornyoot W et al. Randomized control trial comparing calcium hydroxide and mineral trioxide aggregate for partial pulpotomies in cariously exposed pulps of permanent molars. Int Endod J. 2014 Sep;47(9):835-42.
- Hilton TJ, Ferracane JL, Mancl L, Northwest Practice-based Research Collaborative in Evidence-based Dentistry (NWP). Comparison of CaOH with MTA for direct pulp capping: a PBRN randomized clinical trial. J Dent Res. 2013 Jul.92(7 Suppl):16S-22S.
- Nowicka A, Lipski M, Parafiniuk M, Sporniak-Tutak K, Lichota D, Kosierkiewicz A et al. Response of human dental pulp capped with Biodentine and mineral trioxide aggregate. J Endod. 2013 Jun;39(6):743-7.
- Nowicka A, Wilk G, Lipski M, Kołecki J, Buczkowska-Radlińska J. tomographic evaluation of reparative dentin formation after direct pulp capping with Ca(OH)2, MTA, Biodentine, and dentin bonding system in human teeth. J Endod. 2015 Aug;41(8):1234-40.
- Goodis HE, Kahn A, Simon S. Aging and the pulp. In: Hargreaves KM, Goodis HE, Tay FR. Dental pulp Seltzer and Bender’s. Quintessence; 2012, pp. 421-46.
- Bence R. Handbook of clinical endodontics (2nd ed) St Louis: Mosby; 1980, 282 p.
- Simon S, Perard M, Zanini M, Smith AJ, Charpentier E, Djole SX et al. Should pulp chamber pulpotomy be seen as a permanent treatment? Some preliminary thoughts. Int Endod J. 2013 Jan;46(1):79-87.
- Taha NA, Khazali MA. Partial pulpotomy in mature permanent teeth with clinical signs indicative of irreversible pulpitis: a randomized clinical trial. J Endod. 2017 Sep;43(9):1417-21.
- Taha NA, Abdelkhader SZ. Outcome of full pulpotomy using Biodentine in adult patients with symptoms indicative of irreversible pulpitis. Int Endod J. 2018 Aug;51(8):819-28.
- Uesrichai N, Nirunsittirat A, Chuveera P, Srisuwan T, Sastraruji T, Chompu-Inwai P. Partial pulpotomy with two bioactive cements in permanent teeth of 6- to 18-year-old patients with signs and symptoms indicative of irreversible pulpitis: a noninferiority randomized controlled trial. Int Endod J. 2019 Jun;52(6):749-759.
- Projet hospitalier de recherche clinique coordonné par le Pr Stéphane Simon. [En ligne] https://pulpsave.weebly.com. Consulté le 17 septembre 2019
À propos des auteurs
Dr Fleur Bérès
Dr Tchilalo Boukpessi
Dr Maxime Drossart
Dr Nelly Pradelle-Plasse
-
Endodontie
Les clés pour réaliser sereinement des traitements et retraitements endodontiques- Programme intégré
- Action DPC 99F92325002
- 14 h en E-learning
- Éligible DPC (1034 €)
Dernière mise à jour le 1 octobre 2024
![[IDW] Pop_up site (6) [IDW] Pop_up site (6)](https://www.idwebformation.fr/wp-content/uploads/sites/2/elementor/thumbs/IDW-Pop_up-site-6-r7g6k0lwwqaa9sgvj11al249wo7yokzofbzm2qc8lk.png)